150 anni fa Mendeleev mise in ordine il mondo
Il primo marzo del 1869 il chimico russo pubblicò la sua Tavola Periodica degli elementi. Che nel tempo è stata aggiornata ma mai abbandonata. Ora anche l’Unesco la festeggia.
L’inserto “Venerdì di Repubblica” del 22 febbraio 2019, alle pp. 56-59, pubblica questo articolo interessante di Silvia Bencivelli, nell’anno dedicato alla celebrazione della tavola periodica degli elementi.
La tavola periodica degli elementi è una conquista dell’umanità: una conquista scientifica, filosofica e persino estetica, e oggi l’umanità la festeggia. Perché fu 150 anni fa, il 1° marzo del 1869, che il chimico russo Dmitrij Mendeleev pubblicò il suo sistema di classificazione degli elementi risolvendo un enigma su cui gli scienziati si stavano arrovellando da tempo: di che cosa è fatta la materia e come possiamo studiarla? Da allora nella scienza sono cambiate molte cose, ma lei no, o almeno non in materia sostanziale. Come è successo alla tassonomia di Linneo e all’evoluzionismo di Darwin, la tavola periodica di Mendeleev ha saputo accogliere le scoperte che avvenivano man mano nella scienza, incastonandole nel suo sistema di lettura della Natura chiaro e pulito: quello a righe colorate che tutti gli studenti del mondo sono abituati a vedere appeso alle pareti dell’aula scolastica, tra il planisfero e la lavagna.
La decisione dell’Unesco di dedicare il 2019 alla tavola è stata accolta con grande favore nel mondo scientifico. “La tavola periodica ha dato inizio alla chimica e alla fisica, ha permesso di capire le proprietà della materia e soprattutto permette, ancora oggi, di prevederle”, spiega Pietro Tundo, chimico organico e membro della Iupac (International Union of Pure and Applied Chemistry), l’organizzazione scientifica non governativa per la nomenclatura chimica, che compie quest’anno un secolo di vita. “La tavola periodica è elegante, semplice, intuitiva e anch’io, dopo tanti anni che faccio chimica, non la so a memoria, ma mi basta guardarla per prenderne ispirazione”. Il suo valore va anche al di là di quello tecnico. “E’ quello di un patrimonio universale, come la legge di gravitazione universale, ma anche come la Divina Commedia”, aggiunge Marco Ciardi, storico della scienza dell’Università di Bologna che ha appena pubblicato per Hoepli “Il segreto degli elementi. Mendeleev e l’invenzione del sistema periodico” (pp. 160, euro 12,90). “Lì dentro c’è tutto: è una mappa che contiene ogni elemento dell’universo”. E poi, concordano i due, “è bellissima”.
La storia della tavola periodica, come quasi sempre nella scienza, non parte da un genio solitario che armeggia nel suo studiolo e fa la grande scoperta. E’ invece una vicenda di incontri, congressi, scambi, rivalità e colpi di fortuna. Pure qui ci sono le leggende: si dice infatti che sia stato un sogno a dettare a Mendeleev l’intuizione definitiva, cioè quella di ordinare gli elementi secondo il peso atomico. E di lasciare degli spazi vuoti per gli elementi non ancora scoperti. “Ma uno degli aspetti belli di questa storia è che in realtà Mendeleev e gli altri avevano un’esigenza didattica”, racconta ancora Ciardi. “Mendeleev in particolare stava scrivendo un manuale per i propri studenti”.
La trama della storia è complessa. I protagonisti principali sono tre delegazioni a un congresso internazionale che si tiene a Karslruhe (Germania) nel 1860, e due visioni del mondo. Tra le tre delegazioni spicca quella italiana, di cui fa parte il chimico palermitano Stanislao Cannizzaro, che al congresso fa distribuire un proprio lavoro di “filosofia chimica” nel quale dà una definizione di atomo e molecola, e propone un modo per determinarne il peso. Poi ci sono i tedeschi, in particolare c’è il chimico Lothar Meyer. E ci sono i russi, tra cui Aleksandr Borodin (oggi più famoso come musicista) e soprattutto Dmitrij Mendeleev.
Leggendo il lavoro di Cannizzaro, sia Meyer sia Mendeleev intuiscono la periodicità delle caratteristiche degli elementi, cioè capiscono che alcune loro proprietà cambiano in maniera sistematica al crescere del peso atomico e che quindi è possibile metterli in fila come le carte di un solitario. Ma qui entrano in gioco due visioni del mondo. Per Meyer, in linea con il pensiero dei filosofi greci, tutti gli elementi sono multipli dell’idrogeno, cioè del primo elemento, quello con numero atomico 1, quindi la materia è unica. Mentre per Mendeleev l’idea di una materia unica è sorpassata, è un relitto del pensiero classico. Mendeleev, spiega Ciardi, “è kantiano: per lui si deve partire dalle esperienze. Gli elementi per lui sono il punto di giunzione tra la legge morale dentro di noi e il cielo stellato sopra di noi”. E Mendeleev vince: la sua tavola periodica, basata sull’idea di una materia plurale, in cui gli elementi sono tutti diversi, segna la scienza moderna.
“La tavola periodica oggi? E’ la nostra Bibbia, ma è anche una delle icone più potenti della cultura”, si emoziona Eleonora Polo, ricercatrice dell’Isof, Istituto per la sintesi organica e la foto reattività del Cnr di Bologna. “E poi ha resistito a tutto. Alla relatività, alla meccanica quantistica, al progresso”.
Pochi anni dopo la pubblicazione del 1869 vengono scoperti tre elementi nuovi (scandio, gallio e germanio) che riempiono alla perfezione tre delle caselle che Mendeleev aveva lasciato bianche. E piano piano, dai 63 elementi iniziali (dei quali nove conosciuti dall’antichità, come oro rame e ferro, e gli altri quasi tutti scoperti tra ‘700 e ‘800) siamo arrivati ai 118 di oggi, con gli ultimi quattro arrivati nel 2016 (nihonio, moscovio, tennessinio, oganessio). Finiremo mai di riempire la tavola? “Sì, perché atomi grandi devono avere elettroni veloci, ma c’è un limite naturale che non potrà mai essere superato: la velocità della luce. Di conseguenza, c’è un limite anche alla dimensione dell’atomo”. Intanto gli scienziati di tutto il mondo, finalmente in stretta collaborazione, grazie a pochi strumenti potentissimi che si trovano in Russia, Usa, Germania e Giappone, stanno cercando di produrre gli elementi 119 e 120, e c’è chi dice che si potrà arrivare anche a 170. “+Non è un gioco: quando hai scoperto zone nuove della natura puoi fare cose che prima nemmeno immaginavi”, dice Polo.
Per questo l’umanità continua a ringraziare Mendeleev. Nato diciassettesimo di diciassette fratelli, uomo di cultura raffinata, amante dell’Italia, geniale inventore e tecnologo, appassionato democratico e ottimo didatta, ma anche bigamo dichiarato e con abitudini strane (pare che si facesse tagliare barba e capelli una volta all’anno da un tosa pecore siberiano), ci ha lasciato uno strumento unico di comprensione della natura. “Adesso sta a noi usarlo per fare le scelte giuste” conclude Tunso, che nella Iupac ha fondato il comitato permanente Green Chemistry. “La chimica è alla base di tutto. E’ il momento che l’umanità ne prenda coscienza e scelga di indirizzarla verso uno sviluppo sostenibile”. L’anno dedicato alla tavola periodica serve soprattutto a questo.
Silvia Bencivelli
Da Mendeleev a Moseley
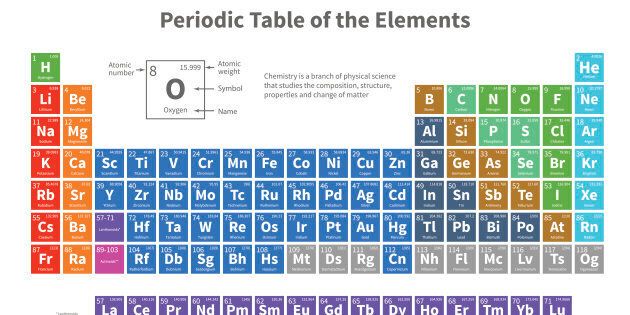
La tavola periodica moderna è uno schema dove gli elementi sono disposti in successione in base al loro numero atomico, ovvero al numero di protoni del nucleo, che coincide con quello degli elettroni. Mendeleev aveva ordinato gli elementi in base alle loro caratteristiche chimiche e fisiche, che riteneva fossero legate al peso atomico dell’elemento. (Questo peso, ma ai tempi di Mendeleev non si sapeva, è determinato da quello dei protoni più quello dei neutroni dell’atomo). Nel 1913 l’inglese Henry Moseley mostrò invece che a determinare le caratteristiche degli elementi non era il peso ma, appunto, il numero atomico. La tavola è distinta in gruppi e periodi. I gruppi (in verticale) riuniscono elementi che hanno le stesse caratteristiche. I periodi elementi le cui caratteristiche chimiche variano in modo graduale. I gruppi sono 18, i periodi 7, seguiti da due file separate, i lantanidi (con le proprietà del lantanio) e gli attinidi (stesse proprietà dell’attinio). I colori identificano le diverse serie chimiche (non metalli, metalli alcalini, alogeni, gas nobili…).
Nota del curatore